超氧化物歧化酶(SOD)家族酶的功能是保護(hù)細(xì)胞免受活性氧的侵害��,特別是通過(guò)將超氧化物自由基(O2·-)轉(zhuǎn)化為分子氧(O2)和過(guò)氧化氫(H2O2)�。它包括SOD1���,一種含銅和鋅的同型二聚體���,幾乎只存在于細(xì)胞胞質(zhì)空間內(nèi)�����;SOD2��,線粒體內(nèi)的含錳四聚體�;以及SOD3�����,一種主要存在于細(xì)胞外基質(zhì)中的含銅和鋅的四聚體��。SOD1是第一個(gè)被了解的家族成員���,已經(jīng)被證實(shí)與肌萎縮側(cè)索硬化癥(ALS)有關(guān)����,ALS是一種嚴(yán)重的運(yùn)動(dòng)神經(jīng)元疾病�,以大腦和脊髓中的運(yùn)動(dòng)神經(jīng)元進(jìn)行性退化為特征。目前還沒(méi)有有效的治療方法��,肌萎縮性側(cè)索硬化癥在發(fā)病后2 - 5年內(nèi)就會(huì)達(dá)到癱瘓和死亡的頂峰,這凸顯了SOD1作為潛在治療靶點(diǎn)的重要性�����。
SOD1在ALS中的作用是什么?
約90%的ALS病例為散發(fā)性(SALS)��,其余10%為家族性(FALS)�����。然而���,這兩種疾病的臨床相似性長(zhǎng)期以來(lái)表明它們具有共同的致病途徑和/或涉及相似的毒性因素3,4���。1993年����,在13個(gè)不同的FALS家族中發(fā)現(xiàn)了11個(gè)不同的SOD1錯(cuò)義突變,現(xiàn)在我們知道SOD1就是這樣一個(gè)因素���。自那以后���,在ALS患者中發(fā)現(xiàn)了超過(guò)150個(gè)SOD1突變(包括點(diǎn)突變和由于過(guò)早終止導(dǎo)致的蛋白截?cái)?�,占所有FALS病例的20-25%和SALS病例的一小部分3,6����。重要的是,ALS相關(guān)的SOD1突變可誘導(dǎo)蛋白質(zhì)在軸突中錯(cuò)誤折疊和聚集���,從而導(dǎo)致神經(jīng)元細(xì)胞死亡�。因此�����,SOD1已成為ALS研究領(lǐng)域中研究最廣泛的基因之一����,并被認(rèn)為是一個(gè)有希望的治療干預(yù)靶點(diǎn)。
突變型SOD1被認(rèn)為驅(qū)動(dòng)ALS的發(fā)病和發(fā)展����,而野生型(WT) SOD1蛋白被認(rèn)為是疾病的重要調(diào)節(jié)因子。支持這一假說(shuō)的主要發(fā)現(xiàn)包括:非遺傳型干擾�,如金屬消耗、氧化和蛋白四級(jí)結(jié)構(gòu)的破壞會(huì)誘導(dǎo)WT型SOD1發(fā)生錯(cuò)誤折疊�。研究發(fā)現(xiàn)從SALS患者脊髓中免疫純化的WT SOD1可以以類似于FALS相關(guān)的突變體的方式抑制基于驅(qū)動(dòng)蛋白的快速軸突運(yùn)輸;數(shù)據(jù)顯示在轉(zhuǎn)基因小鼠中高表達(dá)的WT型人源SOD1加上其它各種突變形式(A4V���、G85R��、G93A��、T116X或L126Z)的人源蛋白會(huì)加速病程3�����,4���,6�。此外�����,一組SALS患者的腦脊液(CSF)的ELISA評(píng)估發(fā)現(xiàn)��,WT SOD1在所有檢查的病例中都存在錯(cuò)誤折疊���;雖然SALS患者的腦脊液(CSF)樣本對(duì)培養(yǎng)的運(yùn)動(dòng)神經(jīng)元樣NSC-34細(xì)胞表現(xiàn)出明顯的毒性,但這種效應(yīng)可以通過(guò)免疫沉淀去除錯(cuò)誤折疊的WT SOD1蛋白來(lái)改善2��。
用于野生型SOD1研究的產(chǎn)品
Stressmarq為研究野生型SOD1的研究人員提供了多種產(chǎn)品�����。這些包括我們的人源重組SOD1蛋白單體(SPR -435)和我們的人源重組SOD1蛋白預(yù)形成的原纖維(SPR -470),它們可以用于研究體外SOD1的聚集���。
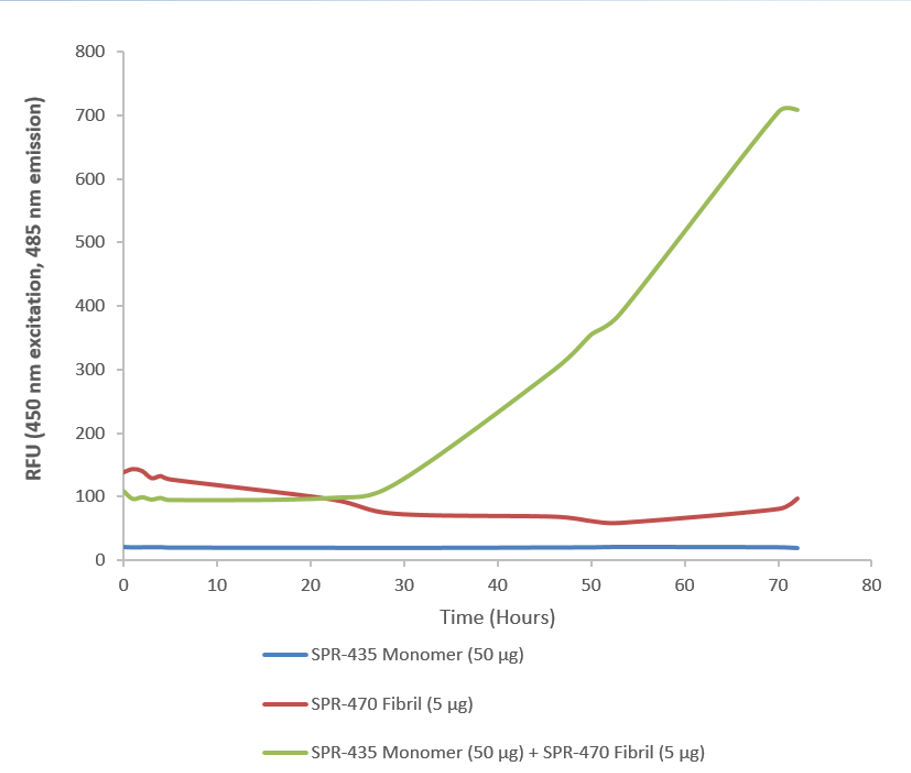
ThT assay of SOD1 pre-formed fibrils (SPR-470) combined with SOD1 monomers (SPR-435).
 ?
?
TEM of human SOD1 pre-formed fibrils (PFFs) (SPR-470)
其他的關(guān)于SOD1產(chǎn)品的信息���,包括實(shí)驗(yàn)步驟,儲(chǔ)存�����,常見(jiàn)問(wèn)題可以參考StressMarq官網(wǎng)�����。
參考文獻(xiàn)
1.?Superoxide dismutase multigene family: a comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression, Zelko IN?et al, Free Radic Biol Med. 2002 Aug 1;33(3):337-49
2.?Wild-type Cu/Zn-superoxide dismutase is misfolded in cerebrospinal fluid of sporadic amyotrophic lateral sclerosis, Tokuda E?et al, Mol Neurodegener. 2019 Nov 19;14(1):42
3.?An emerging role for misfolded wild-type SOD1 in sporadic ALS pathogenesis, Rotunno MS and Bosco DA, Front Cell Neurosci. 2013 Dec 16;7:253
4.?Wild-type and mutant SOD1 share an aberrant conformation and a common pathogenic pathway in ALS, Bosco DA?et al, Nat Neurosci. 2010 Nov;13(11):1396-403
5.?Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis, Rosen DR?et al, Nature. 1993 Mar 4;362(6415):59-62
6.?An examination of wild-type SOD1 in modulating the toxicity and aggregation of ALS-associated mutant SOD1, Prudencio M?et al, Hum Mol Genet. 2010 Dec 15;19(24):4774-89
詳情請(qǐng)咨詢StressMarq全國(guó)授權(quán)一級(jí)代理-欣博盛生物科技?
全國(guó)服務(wù)熱線: 4006-800-892 ? ? ??郵箱: market@neobioscience.com?
深圳: 0755-26755892 ? ? ? ??北京: 010-88594029 ? ? ? ??上海: 021-34613729???????????
廣州:?020-87615159? ? ? ? ? ?香港: 852-69410778?
代理品牌網(wǎng)站: m.yuebanme.com?
自主品牌網(wǎng)站: www.neobioscience.net